La mayor parte de las propiedades de las soluciones dependen de su soluto, sin embargo hay 4 propiedades físicas que se afectan igualmente con todos los solutos no volátiles: la disminución de la presión de vapor [Pvap], la elevación del punto de ebullición, la disminución del punto de congelación y la presión osmótica. Las propiedades coligativas de las soluciones solo dependerán de la cantidad de partículas disueltas.
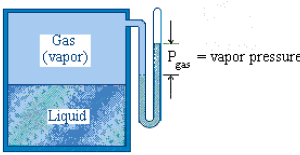
Todos los sólidos y líquidos producen vapores consistentes en átomos o moléculas que se han evaporado de sus formas condensadas. Si la sustancia, sólida o líquida, ocupa una parte de un recipiente cerrado, las moléculas que escapan no se pueden difundir ilimitadamente sino que se acumulan en el espacio libre por encima de la superficie del sólido o el líquido, y se establece un equilibrio dinámico entre los átomos y las moléculas que escapan del líquido o sólido y las que vuelven a él. La presión correspondiente a este equilibrio es la presión de vapor y depende sólo dela naturaleza del líquido o el sólido y de la temperatura, pero no depende del volumen del vapor.
Cuando se prepara una solución con un solvente y un soluto no volátil (que se transformará en gas) y se mide su presión, al compararla con la presión de vapor de su solvente puro (medidas a la misma temperatura), se observa que la de la solución es menor que la del solvente. Esto es consecuencia de la presencia del soluto no volátil.
A su vez, cuando se comparan las presiones de vapor de dos soluciones de igual composición y diferente concentración, aquella solución más concentrada tiene menor presión de vapor. El descenso de ésta se produce por dos razones: por probabilidad, pues es menos probable que existan moléculas de disolvente en el límite de cambio, y por cohesión, pues las moléculas de soluto atraen a las de disolvente por lo que cuesta más el cambio.
La presión de vapor de un disolvente desciende cuando se le añade un soluto no volátil.
Este efecto es el resultado de dos factores:
1. la disminución del número de moléculas del disolvente en la superficie libre
2. la aparición de fuerzas atractivas entre las moléculas del soluto y las moléculas del disolvente, dificultando su paso a vapor
Cuanto más soluto añadimos, menor es la presión de vapor observada. La formulación matemática de este hecho viene expresada por la observación de Raoult (foto de la izquierda) de que el descenso relativo de la presión de vapor del disolvente en una disolución es proporcional a la fraccion molar del soluto
Si representamos por P la presión de vapor del disolvente, P' la presión de vapor de la disolución y Xs la fracción molar del soluto, la ley de Raoult se expresa del siguiente modo:
de donde se obtiene que :
con lo que:
Esta fórmula nos permite enunciar la ley de Raoult: la presión de vapor de la disolución es igual a la presión de vapor del disolvente por la fracción molar del disolvente en la disolución. Esta fórmula tiene validez para todas las disoluciones verdaderas.
Cuando se trabaja con disoluciones diluidas como las biológicas, cuya molalidad oscila entre 0 y 0,4, se puede utilizar una fórmula aproximada. Si por ejemplo, la molalidad m = 0,4 hay 0,4 moles de soluto en 1000 g de agua, o lo que es lo mismo, 0,4 moles de soluto por cada 55,5 moles de agua, ya que 1000 g de agua (peso molecular =18) son 55,5 moles:
Por otro lado, la fracción molar del soluto (Xs) es:
y por lo tanto,
De acuerdo con esta fórmula, el descenso relativo de la presión de vapor es proporcional a la molalidad, si la disolución es diluída.
La presión de vapor en los líquidos crece rápidamente al aumentar la temperatura; así, cuando la presión de vapor es igual a 1 atmósfera, el líquido se encuentra en su punto de ebullición ya que el vapor, al vencer la presión exterior, se puede formar en toda la masa del líquido y no sólo en su superficie.
Cuando un soluto no volátil se disuelve en un líquido disminuye la presión de vapor del disolvente, pues las moléculas de soluto, al ser de mayor volumen, se comportan como una barrera que impide el paso de las moléculas de disolvente al estado de vapor.
De acuerdo a lo anterior es como podemos encontrar la relación que existe entre la presión de vapor y el punto de ebullición: La temperatura de ebullición de un líquido es aquella a la cual su presión de vapor iguala a la presión atmosférica.
Cualquier disminución en la presión de vapor (como lo que se sucede al añadir un soluto no volátil) producirá un aumento en la temperatura de ebullición.
La elevación de la temperatura de ebullición es proporcional a la fracción molar del soluto. Este aumento en la temperatura de ebullición es proporcional a la concentración molal del soluto.
En la siguiente entrada trataré a mayor profundidad el tema de Aumento del Punto de Ebullicion