La importancia de la presión osmótica en los sistemas vivos es evidente. Sin embargo, antes de hablar de ésta propiedad, es importante aclarar un par de conceptos y que el tema pueda ser bien entendido.
La difusión es el proceso mediante el cual las moléculas del soluto tienden a alcanzar una distribución homogénea en todo el espacio que pueden ocupar después de cierto tiempo. En Biología es especialmente importante el fenómeno de difusión a través de membranas, ya que la presencia de las membranas biológicas condiciona el paso de disolvente y solutos en las estructuras celulares.
En la imagen anterior queda ejemplificado cómo es este proceso de difusión. Las moléculas del colorante al estar en contacto con el medio acuoso comienzan a distribuirse por todo el disolvente hasta que queda una sustancia de color homogeneo.
La presencia de una membrana separando dos medios diferentes impone ciertas restricciones al proceso de difusión de solutos, que dependerán fundamentalmente de la relación entre el diámetro de los poros de la membrana y el tamaño de las partículas disueltas. Las membranas se clasifican en cuatro grupos:
impermeables: no son atravesadas ni por solutos ni por el disolvente
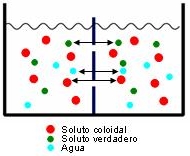
semipermeables: no permiten el paso de solutos verdaderos, pero sí del agua
dialíticas: son permeables al agua y solutos verdaderos, pero no a los solutos coloidales
permeables: permiten el paso del disolvente y de solutos coloidales y verdaderos; sólo son impermeables a las dispersiones groseras
El siguiente concepto de iportancia para explicar el fenómeno de la presión oesmótica es la ósmosis. La ósmosis es la difusión de líquidos a través de membranas. Supongamos una disolución de NaCl separada del disolvente por una membrana semipermeable que permite el paso del agua pero no de la sal. El agua tiende a atravesar la membrana, pasando de la disolución más diluída a la más concentrada, o sea, en el sentido de igualar las concentraciones. Esta tendencia obedece al segundo principio de la termodinámica y se debe a la existencia de una diferencia en la presión de vapor entre las dos disoluciones. El equilibrio se alcanza cuando a los dos lados de la membrana se igualan las concentraciones, ya que el flujo neto de agua se detiene.
Con los conceptos anteriores, es posible entonces definir a la presión osmotica.
Se define la presión osmótica como la tendencia de una disolución separada del disolvente puro por una membrana semipermeable a diluirse. Un soluto ejerce presión osmótica al enfrentarse con el disolvente sólo cuando no es capaz de atravesar la membrana que los separa. La presión osmótica de una disolución equivale a la presión mecánica necesaria para evitar la entrada de agua cuando está separada del disolvente por una membrana semipermeable.
 Para medir la presión osmótica se utiliza el osmómetro, que consiste en un recipiente cerrado en su parte inferior por una membrana semipermeable y con un émbolo en la parte superior. Si introducimos una disolución en el recipiente y lo sumergimos en agua destilada, el agua atraviesa la membrana semipermeable y ejerce una presión capaz de elevar el émbolo hasta una altura determinada. Sometiendo el émbolo a una presión mecánica adecuada se puede impedir que pase el agua hacia la disolución, y el valor de esta presión mecánica mide la presión osmótica.
Para medir la presión osmótica se utiliza el osmómetro, que consiste en un recipiente cerrado en su parte inferior por una membrana semipermeable y con un émbolo en la parte superior. Si introducimos una disolución en el recipiente y lo sumergimos en agua destilada, el agua atraviesa la membrana semipermeable y ejerce una presión capaz de elevar el émbolo hasta una altura determinada. Sometiendo el émbolo a una presión mecánica adecuada se puede impedir que pase el agua hacia la disolución, y el valor de esta presión mecánica mide la presión osmótica. Las leyes que regulan los valores de la presión osmótica para disoluciones muy diluídas, como las que se manejan en Biología, son análogas a las leyes de los gases. Se conocen con el nombre de su descubridor Jacobus H. Van t'Hoff y se expresan mediante la siguiente fórmula:
p= m R T
donde p representa la presión osmótica, m es la molalidad de la disolución, R es la constante universal de los gases y T es la temperatura absoluta.
Si comparamos la presión osmótica de dos disoluciones podemos definir tres tipos de disoluciones:
disoluciones isotónicas son aquéllas que manifiestan la misma presión osmótica que la disolución de referencia
disoluciones hipotónicas son aquéllas que manifiestan menor presión osmótica que la disolución de referencia
disoluciones hipertónicas son aquéllas que manifiestan mayor presión osmótica que la disolución de referencia
La membrana del eritrocito puede considerarse como una membrana semipermeable, que permite el paso del agua, pero no de las sales. En un medio isotónico (de igual presión osmótica), el eritrocito permanece inalterable. Si el eritrocito se introduce en agua destilada o en un medio hipotónico el agua atravesará la membrana hacia el citoplasma, con lo que aumenta el volumen celular, distendiendo la membrana hasta que llega un punto en que ésta se rompe. Este fenómeno se conoce con el nombre de hemolisis. Si el eritrocito se pone en un medio hipertónico (de mayor presión osmótica), el agua sale del eritrocito hacia el exterior, con lo cual su volumen disminuye, y la membrana se retrae, de forma que ofrece al microscopio un aspecto estrellad.
Resulta, por tanto, vital para la célula mantener constante la presión osmótica del medio intersticial. Cuando la célula se encuentra en un medio donde la osmolaridad es distinta a la de su medio interno, tanto su funcionamiento como su propia integridad se encontrarán amenazados.







No hay comentarios:
Publicar un comentario